- 📋 Wprowadzenie
- 📋 Zasięg występowania
- 🔬 Morfologia
- 📉 Biologia i szkodliwość
- 🔄 Rozprzestrzenianie
- 📋 Status fitosanitarny
- 🔬 Morfologia
- 🔄 Cykl życiowy
- 🌿 Rośliny żywicielskie
- ⚠️ Objawy i szkody
- 💰 Znaczenie ekonomiczne
- 🌍 Rozmieszczenie i historia inwazji
- 🛡️ Metody zwalczania
- 🔍 Metody wykrywania i monitoringu
- 📋 Status kwarantannowy
- 📷 Galeria
- ⚠️ Postępowanie przy wykryciu
- Szczegółowa charakterystyka i taksonomia
- Biologia i cykl rozwojowy
- Metody diagnostyczne
- Znaczenie gospodarcze i straty ekonomiczne
- Regulacje prawne i status kwarantannowy
📋 Wprowadzenie
Aromia bungii reprezentuje owada z grupy kózkowatych (Cerambycidae) wywodzącego się z regionu azjatyckiego, który stanowi istotne niebezpieczeństwo dla drzewostanu jesionowego na terenie Europy.
📋 Zasięg występowania
Dokładny obszar naturalnego rozmieszczenia tego organizmu pozostaje nieustalony. Jego obecność dokumentowano w Państwie Środka, Japonii, obu częściach Półwyspu Koreańskiego, Mongolii, na Tajwanie oraz w Wietnamie. Pierwszy przypadek stwierdzenia tego szkodnika w Europie miał miejsce w 2011 roku w Niemczech, następnie w 2012 roku zarejestrowano go we Włoszech. Odnotowano również incydenty przechwycenia agrofaga na materiałach opakowaniowych z drewna na terytorium Wielkiej Brytanii.
🔬 Morfologia
Stadia larwalne charakteryzują się budową typową dla młodych form owadów z rodziny kózkowatych. Posiadają podłużne, dorsoventralnie spłaszczone ciało. Aparat gębowy jest wsunięty w poszerzony segment przedpiersiowy. W pełni rozwinięta larwa może mierzyć 38-50 mm. Charakteryzuje się bladą kolorystyką z ciemną częścią głowową, w przedniej części tułowia obecny jest czerwonobrązowy, nieregularny pas.
Poczwarka należy do typu swobodnego, przypominająca kształtem formę imago. Wykazuje biały odcień zabarwienia. Dorosłe osobniki osiągają rozmiar 23-37 mm długości. Ich sylwetka jest wydłużona, błyszcząca, o ciemnoniebieskim kolorze z wyjątkiem przedplecza prezentującego czerwone ubarwienie. Aparaty czuciowe sięgają do końca ciała lub go przekraczają.
📉 Biologia i szkodliwość
Aspekty biologiczne tego agrofaga nie zostały dokładnie poznane. Obserwuje się go w ekosystemach leśnych, uprawach ogrodniczych oraz atakuje nasadzenia miejskie. Samice deponują jaja w nacięciach warstwy korowej, przeważnie na głównych pniach, lecz także na większych odnogach, wybierając zarówno zdrowe, jak i osłabione okazy.
Stadia larwalne przebywają swój rozwój wewnątrz struktury roślinnej, w wykuwanych przez siebie tunelach. Młode formy powodują uszkodzenia różnych części drzewa, penetrują w głąb tworząc spłaszczone w przekroju galerie. Obecność larw wewnątrz rośliny może być sygnalizowana przez gromadzące się u podstawy pni ekskrety i czerwonawą spilę, której objętość wzrasta wraz z rozwojem żerujących stadiów.
Na zakończeniu galerii lokalizuje się komora poczwarkowa, gdzie realizuje się przemiana. Chrząszcz wydostaje się z miejsca przeobrażenia poprzez cylindryczny korytarz i otwór wyjściowy, najczęściej umieszczony w dolnej partii pnia zaatakowanego drzewa. Zanotowano, że stadia preimaginalne mogą kontynuować życie w ściętych drzewach. Dojrzałe larwy i poczwarki są zdolne do ukończenia w nich metamorfozy i przekształcenia w dorosły organizm.
W Państwie Środka A. bungii uznawany jest za istotny czynnik szkodotwórczy w hodowlach roślin z rodzaju Prunus, szczególnie na brzoskwiniach i morelach. Dodatkowo jest to szkodnik technologiczny drewna, pogarszający jakość surowca drzewnego.
🔄 Rozprzestrzenianie
Organizm ekspanduje naturalnie poprzez przemieszczanie się dorosłych form. Ten gatunek jest także przenoszony wraz z transportem zainfekowanego materiału, głównie roślin oraz w opakowaniach drewnianych, w których znajdują się młode stadia rozwojowe tego agrofaga.
📋 Status fitosanitarny
W strukturach Unii Europejskiej, a tym samym w Polsce, gatunek A. bungii podlega obowiązkowi zwalczania (jest to agrofag kwarantannowy w Unii).
🔬 Morfologia
Stadium dorosłe: długość 22–38 mm (niektóre źródła wskazują 28–31 mm). Charakterystyczna kolorystyka: błyszczące czarne nadskrzydła i jaskrawoczerwony przedtułów – stąd potoczne określenie „kózka czerwonoszyjka” (red neck longhorn beetle).
Aparaty czuciowe u osobników męskich przekraczają długość ciała, u samic dorównują długości ciała.
Stadium larwalne: świeżo wyklute 2–2,5 mm, dojrzałe 38–50 mm. Ciało białawe z ciemnymi zakończeniami i podstawami żuwaczek. Charakterystyczny czerwonawy wzór czołowy na przedtułowiu.
Jajo: ~2 mm długości, białawe, lokowane w szczelinach kory.
Poczwarka: swobodna, biaława, 26–36 mm długości, formowana w komorze poczwarkowej w drewnie.
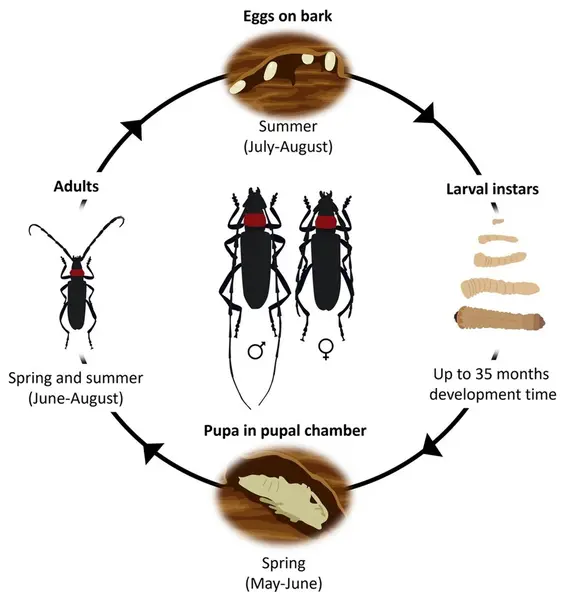
🔄 Cykl życiowy
Przebieg ontogenezy wynosi 2–4 lata w zależności od szerokości geograficznej i warunków klimatycznych.
Aktywność imago: czerwiec–sierpień.
Etapy rozwoju:
- Wylęg jaj następuje po ~1 tygodniu
- Larwy natychmiast po wykluciu inicjują drążenie galerii
- Poczwarczenie w połowie maja (obserwacje z Włoch)
- Dorosłe osobniki żyją 15–20 dni
Reprodukcyjność: samice deponują 350–730 jaj podczas życia – bardzo wysoki potencjał rozmnażania.
🌿 Rośliny żywicielskie
Gatunek oligofagiczny, głównie powiązany z rodzajem Prunus:
- Brzoskwinia (Prunus persica) – podstawowy żywiciel, największe uszkodzenia
- Morela (Prunus armeniaca) – wysoce podatna
- Śliwa (Prunus domestica)
- Czereśnia i wiśnia (Prunus avium, P. cerasus)
- Migdał (Prunus dulcis)
- Gatunki dekoracyjne z rodzaju Prunus
Inne potwierdzone żywiciele: kasztanowiec chiński, orzech włoski, dąb – choć dokumentacja jest mniej pewna.
⚠️ Objawy i szkody
Stadia larwalne wytwarzają galerie w drewnie. Żerowanie w strefie kambialnej blokuje transport soków, wywołując nekrozę tkanek, osłabienie drzewa i ograniczenie owocowania.
Obserwowalne symptomy:
- Akumulacja czerwonawego trocinu u podstawy pnia
- Otwory wyjściowe po opuszczeniu przez chrząszcze
- Usychanie i zamieranie gałęzi
- Łamanie konaru w miejscach osłabionych tunelami
Intensywne porażenie prowadzi do obumierania drzew.
Organizm określany jako „wysoce destrukcyjny” na brzoskwini i moreli, wywołuje istotne uszkodzenia na śliwach i czereśniach.
💰 Znaczenie ekonomiczne
Aromia bungii stanowi emerging szkodnika w leśnictwie i sadach owocowych.
W regionie EPPO dotychczas nie zanotowano istotnych strat w profesjonalnych sadach – większość ataków występuje w prywatnych ogrodach i niewielkich gospodarstwach.
Potencjalne zagrożenie dla europejskiej produkcji owoców pestkowców jest jednak bardzo znaczące ze względu na:
- Bardzo wysoką rozrodczość (do 730 jaj/samicę)
- Trudności w zwalczaniu ukrytych larw
- Szeroki zakres żywicieli w rodzaju Prunus
- Potwierdzoną zdolność do zadomowienia w warunkach europejskich
🌍 Rozmieszczenie i historia inwazji
Obszar rodzimy: południowo-wschodnia Palearktyka – Chiny, Korea, Wietnam, Mongolia.
Introdukcja do Japonii: 2012 r.
Wykrycia w Europie:
- Niemcy (Bawaria): 2011, 2016
- Włochy – Kampania: 2012, 2016
- Włochy – Lombardia: 2013
Ścieżki introdukcji: opakowania drewniane i materiał rozmnożeniowy – wymagane protokoły kontroli i zabiegi zgodne z ISPM 15.
🛡️ Metody zwalczania
Główny problem: eliminacja A. bungii jest bardzo trudna, ponieważ larwa szybko penetruje pod korę i nie może być skutecznie zwalczana insektycydami.
Metoda podstawowa: usuwanie i eliminacja zaatakowanych drzew.
Zwalczanie chemiczne: niektóre insektycydy sadownicze mogą redukować populację dorosłych osobników, ale efektywność wobec larw jest minimalna.
Kontrola biologiczna (badania w Chinach):
- Grzyby entomopatogenne
- Nicienie entomopatogenne
- Kombinacje czynników biologicznych
🔍 Metody wykrywania i monitoringu
Kontrola wizualna:
- Obserwacja akumulacji trocin u podstawy drzew
- Poszukiwanie dorosłych osobników (aktywność diurna, łatwe rozpoznanie dzięki czerwonemu przedtułowiu)
- Kontrola otworów wyjściowych
Pułapkowanie: pułapki butelkowe z płynami fermentującymi wykazują słabą efektywność. Próby polowe z wabikiem (E)-2-cis-6,7-epoksynonenal wykazały skuteczne odławianie w Japonii i Chinach.
Metody molekularne:
- Amplifikacja PCR genów rybosomalnego 28S i mitochondrialnego COI
- Sekwencjonowanie genu COI – działa we wszystkich stadiach rozwojowych
📋 Status kwarantannowy
Lista A2 EPPO, organizm kwarantannowy UE objęty środkami nadzwyczajnymi (załącznik II B).
Wymagane środki fitosanitarne:
- Protokoły kontroli dla materiału rozmnożeniowego
- Zabiegi opakowań drewnianych zgodnie z ISPM 15
- Strefy buforowe wokół wykrytych ognisk
- Obowiązkowe usuwanie porażonych drzew
📷 Galeria
⚠️ Postępowanie przy wykryciu
Aromia bungii jest agrofagiem priorytetowym dla którego opracowano plan awaryjny. W przypadku podejrzenia wystąpienia należy niezwłocznie powiadomić PIORiN. Kontrola obejmuje lustracje drzew pestkowych (głównie śliw, wiśni, brzoskwiń) oraz wyszukiwanie charakterystycznych otworów wylotowych i żerowisk larw pod korą. Porażone drzewa podlegają usunięciu i zniszczeniu. Szczegółowe procedury określa plan awaryjny PIORiN.
Szczegółowa charakterystyka i taksonomia
Aromia bungii (Faldermann, 1835) znany również jako wschodnioazjatycki chrząszcz brzoskwiniowy, reprezentuje jeden z najbardziej ekspansywnych gatunków owadów z rodziny kózkowatych (Cerambycidae). Takson został pierwotnie scharakteryzowany przez Faldermmanna w 1835 roku jako Cerambyx bungii. W trakcie ewolucji klasyfikacji przechodził przez liczne modyfikacje nomenklatury, funkcjonując między innymi pod nazwami Aromia cyanicornis Guérin-Méneville (1844), Callichroma bungii Bates oraz Callichroma ruficolle Redtenbacher (1868). Obecnie obowiązującą nazwą jest Aromia bungii (Faldermann, 1835), która została ustanowiona w oparciu o zasady nomenklatury zoologicznej.
Położenie systematyczne organizmu umieszcza go w obrębie plemienia Callichromatini, podrodziny Cerambycinae w rodzinie Cerambycidae. Kod EPPO dla tego takonu to AROMBU. W literaturze naukowej występuje również specyficzna odmiana barwna A. bungii var. cyanicornis, która wyróżnia się całkowicie czarną kolorystyką w odróżnieniu od typowej formy z czerwonym przedpleczem. Organizm wykazuje oligofagiczny typ żywienia, koncentrując się głównie na roślinach z rodzaju Prunus, co czyni go szczególnie niebezpiecznym dla upraw owocowych w strefie umiarkowanej.
Biologia i cykl rozwojowy
Ontogeneza Aromia bungii charakteryzuje się znaczną elastycznością czasową, trwając od 2 do 4 lat w zależności od warunków klimatycznych i położenia geograficznego. Dojrzałe osobniki osiągają długość 20-40 mm, przy czym samce wyróżniają się antenami przewyższającymi długość ciała, podczas gdy u samic aparaty czuciowe dorównują długości ciała. Okres aktywności trwa od czerwca do sierpnia, z maksimum aktywności dorosłych form przypadającym między połową lipca a początkiem sierpnia w warunkach europejskich. W Chinach optymalne warunki rozwoju występują przy średnich temperaturach miesięcznych przekraczających 15°C.
Samica deponuje 350-730 jaj w ciągu swojego 15-20 dniowego istnienia, umieszczając je w szczelinach warstwy korowej na pniach i głównych gałęziach żywych drzew. Jaja o długości około 2 mm wykluwają się po tygodniu, a młode larwy natychmiast rozpoczynają żerowanie pod korą. Larwy osiągają 38-50 mm długości i charakteryzują się bladym ubarwieniem z ciemnymi końcówkami żuwaczek oraz symetrycznym czerwonawym paskiem na przedniej części przedtułowia. Przepoczwarczenie następuje w komorze poczwarkowej wykutej w drewnie, gdzie poczwarki osiągają długość 26-36 mm. Kompletne systemy tuneli mogą osiągnąć długość 50-60 cm, znacznie osłabiając strukturę drewna.
Metody diagnostyczne
Identyfikacja Aromia bungii opiera się na protokole EPPO PM 7/156, który szczegółowo określa procedury rozpoznawania wszystkich stadiów rozwojowych. Wykrywanie infestacji w warunkach terenowych bazuje na obserwacji charakterystycznych symptomów, w tym akumulacji czerwonawego trocinu u podstawy pni, występowania owalnych otworów wylotowych o wymiarach 6-10 × 10-16 mm oraz obecności dorosłych osobników o charakterystycznym ubarwieniu. Rozpoznanie morfologiczne imago jest stosunkowo proste ze względu na unikalną kombinację czarnych pokryw i czerwonego przedplecza u formy typowej.
Diagnostyka molekularna wykorzystuje sekwencjonowanie genów 28S rRNA oraz mitochondrialnego cytochromu c oksydazy (COI), przy czym sekwencje COI są dostępne w bazie GenBank. Opracowano również testy PCR w czasie rzeczywistym z sondą TaqMan oraz test LAMP umożliwiający wykrywanie DNA A. bungii w trocinie larwalnym, jednak metody te wymagają dalszej walidacji w laboratoriach diagnostycznych EPPO. Testy molekularne mogą być stosowane do wszystkich stadiów rozwojowych, co jest szczególnie istotne dla jaj i poczwarek, dla których brakuje odpowiednich kluczy morfologicznych. W przypadku uszkodzonych okazów dorosłych, analiza molekularna stanowi jedyną wiarygodną metodę identyfikacji gatunkowej.
Znaczenie gospodarcze i straty ekonomiczne
Aromia bungii stanowi poważne niebezpieczeństwo ekonomiczne dla europejskiego sektora sadownictwa, szczególnie w kontekście upraw Prunus spp. W Chinach, gdzie organizm występuje naturalnie, jest klasyfikowany jako jeden z najdestrukcyjniejszych szkodników brzoskwiń i moreli, wywołując znaczne straty w sadach komercyjnych. Larwy, żerując w strefie kambium, przerywają cyrkulację soków, co prowadzi do nekrozy tkanek, osłabienia drzew i redukcji plonowania. Intensywne infestacje skutkują śmiercią całych drzew, co może prowadzić do konieczności likwidacji całych plantacji.
W Europie do 2020 roku odnotowano ogniska w Niemczech (Bawaria, 2011 i 2016), we Włoszech (Kampania 2012 i 2016, Lombardia 2013), gdzie implementowano zarówno środki eradykacyjne jak i kontrolne. Analiza ognisk we Włoszech wykazała tempo rozprzestrzeniania się około 2 km w ciągu 6 lat w Lombardii, podczas gdy w Kampanii organizm osiągnął zasięg 5 km w tym samym okresie. Brak jest szczegółowych danych dotyczących strat ekonomicznych w regionie EPPO, głównie ze względu na szybkie wdrożenie środków fitosanitarnych, jednak potencjał szkodliwości jest oceniany jako bardzo wysoki, szczególnie w południowych krajach europejskich gdzie cykl rozwojowy jest krótszy, a główne rośliny żywicielskie występują licznie.
Regulacje prawne i status kwarantannowy
Aromia bungii figuruje na liście A2 EPPO jako organizm szkodliwy zalecany do regulacji jako szkodnik kwarantannowy. W Unii Europejskiej organizm został sklasyfikowany w kategorii środków nadzwyczajnych oraz jako szkodnik kwarantannowy A2 zgodnie z Aneksem II B odpowiednich regulacji fitosanitarnych. Status ten wymaga implementacji specjalnych środków ochronnych podczas importu materiału roślinnego oraz drewna opakowaniowego z krajów, gdzie takson występuje naturalnie lub został introdukowany.
EPPO zaleca szereg środków fitosanitarnych zgodnie z analizą ryzyka z 2014 roku, w tym wizualne kontrole w miejscu produkcji oraz kontrolę przesyłek w ramach systemu kompleksowego podejścia. Rośliny do sadzenia z rodzaju Prunus powinny pochodzić z obszarów wolnych od szkodnika lub być produkowane w warunkach zabezpieczonych przed owadami. Towary drewna Prunus muszą pochodzić z obszarów wolnych od agrofaga lub być poddane obróbce cieplnej, napromienianiu lub rozdrabnianiu. Materiał opakowaniowy z drewna musi być traktowany zgodnie z ISPM 15. Import roślin do sadzenia Prunus jest już zakazany w wielu krajach EPPO, co stanowi skuteczną barierę przeciwko introdukcji tego inwazyjnego gatunku.