🌍 Występowanie
Pantoea stewartii ssp. stewartii to bakteria wywołująca bakteryjne więdnięcie kukurydzy, występująca w wielu regionach świata. Patogen został stwierdzony w Azji, obejmując Chiny, Filipiny, Indie, Malezję i Tajlandię. W Afryce notowano go w Beninie i Togo. Na kontynencie amerykańskim bakteria występuje w Ameryce Północnej (Kanada, Meksyk, Stany Zjednoczone), Ameryce Środkowej (Kostaryka, Portoryko, Trynidad i Tobago) oraz Ameryce Południowej (Argentyna, Boliwia, Gujana, Peru).
W Europie patogen został wykryty w kilku krajach, w tym w Słowenii, we Włoszech, w Rosji i na Ukrainie. Obecnie bakteria nie występuje w Polsce, chociaż w przeszłości została przechwycona na nasionach kukurydzy wyprodukowanych w naszym kraju, co świadczy o potencjalnym zagrożeniu.
🌱 Rośliny żywicielskie
Podstawowym żywicielem bakterii jest kukurydza (Zea mays), przy czym szczególną wrażliwością charakteryzuje się kukurydza cukrowa. Porażeniu ulegają również inne typy kukurydzy, w tym kukurydza koński ząb, kukurydza twarda, kukurydza mączysta oraz kukurydza pękająca.
Jako alternatywny żywiciel wskazywana jest trawa Setaria pallidefusca. Sporadycznie bakterię stwierdzano również na innych gatunkach roślin, takich jak chlebowiec różnolistny (Artocarpus heterophyllus), dracena Sandera (Dracaena sanderiana), Tripsiacum dactyloides, Zea maxicana oraz na różnych przedstawicielach rodziny wiechlinowatych (Poaceae).
⚠️ Objawy porażenia
Nasiona kukurydzy porażone przez bakterię nie wykazują zewnętrznych objawów infekcji. Pierwsze symptomy choroby mogą pojawić się już we wczesnym stadium rozwoju rośliny, w fazie siewki, gdy może nastąpić więdnięcie młodych roślin. W przypadku późniejszej infekcji rośliny osiągają większe rozmiary przed ujawnieniem się objawów.
Charakterystycznymi symptomami są zmiany w wyglądzie liści, które stają się jasnozielone do żółtych, z podłużnymi smugami i nieregularnymi lub pofałdowanymi brzegami. Wzdłuż unerwienia liścia pojawiają się początkowo krótkie, nieregularne, opalizująco-zielone do żółtych smugi, powstające w miejscach żerowania wektora bakterii – chrząszczy Chaetocnema pulicaria. Tkanka blaszki liściowej w obrębie tych smug stopniowo wysycha i brązowieje.
Na łuskach kolb mogą pojawiać się małe wodniste plamy, które w warunkach wysokiej wilgotności prowadzą do wycieku kropli śluzu bakteryjnego na wewnętrznej powierzchni łuski. Rośliny, które przeżyją infekcję, mogą wytworzyć zbielałe, martwe kwiatostany. W przypadku silnego porażenia w rdzeniu dolnej części łodygi, przy powierzchni gleby, powstają zagłębienia.
Więdnięcie liści jest szczególnie widoczne po okresie kwitnienia. Całe liście przyjmują barwę słomkową i zamierają, a osłabione chorobą rośliny wykazują zwiększoną podatność na grzybową zgniliznę łodygi.
📉 Szkodliwość
Bakteryjne więdnięcie kukurydzy jest chorobą o znacznym potencjale szkodliwości, wywołującą poważne obniżenie plonów. Straty w zbiorach kukurydzy mogą wynosić od kilkudziesięciu procent do całkowitej utraty plonu, w skrajnych przypadkach sięgając 100%. Choroba stanowi zatem istotne zagrożenie ekonomiczne dla producentów kukurydzy w regionach, gdzie patogen występuje.
🔄 Sposoby rozprzestrzeniania
W warunkach naturalnych bakteria rozprzestrzenia się głównie przy pomocy wektora – chrząszczy z gatunku Chaetocnema pulicaria. Prawdopodobnie w przenoszeniu patogena mogą uczestniczyć także skoczki. Transport bakterii na większe odległości następuje z materiałem siewnym – porażonymi nasionami kukurydzy, co stanowi główną drogę międzynarodowego rozprzestrzeniania się patogena.
🛡️ Zwalczanie
Podstawowym sposobem zapobiegania chorobie jest stosowanie zdrowego materiału siewnego, wolnego od patogena. Istotne znaczenie ma również kontrola wektorów – owadów przenoszących bakterię. W przypadku podejrzenia wystąpienia bakterii w uprawach kukurydzy konieczne jest zgłoszenie tego faktu do właściwej terytorialnie jednostki Państwowej Inspekcji Ochrony Roślin i Nasiennictwa.
⚖️ Status prawny
W Unii Europejskiej, w tym w Polsce, Pantoea stewartii ssp. stewartii (wcześniej klasyfikowana jako Erwinia stewartii ssp. stewartii) podlega obowiązkowi zwalczania jako agrofag kwarantannowy. Wymaga to szczególnego nadzoru fitosanitarnego nad importowanym materiałem siewnym kukurydzy oraz monitoringu krajowych upraw w celu wczesnego wykrycia ewentualnego pojawienia się choroby.
📚 Źródła
- Ulotka informacyjna PIORiN (PDF)
- EPPO Global Database
Szczegółowa charakterystyka i taksonomia
Pantoea stewartii subsp. stewartii (Smith) Mergaert, Verdonck & Kersters należy do rodziny Enterobacteriaceae w obrębie rzędu Enterobacterales. Organizm ten przeszedł znaczące zmiany taksonomiczne od momentu pierwszego opisu przez Smitha w 1898 roku. Początkowo klasyfikowany był jako Pseudomonas stewartii Smith, następnie przemianowany na Bacterium stewartii (Smith) Smith oraz Erwinia stewartii (Smith) Dye w 1963 roku. W 1939 roku Dowson zaproponował nazwę Xanthomonas stewartii (Smith) Dowson.
Przełomowy moment w systematyce tego patogena nastąpił w 1993 roku, gdy Mergaert i współpracownicy na podstawie analizy wzorców elektroforezy białek oraz badań hybrydyzacji DNA-DNA dokonali rewizji rodzaju Erwinia. W rezultacie E. stewartii została przeniesiona do rodzaju Pantoea z jednoczesnym utworzeniem dwóch odrębnych podgatunków: P. stewartii subsp. stewartii oraz P. stewartii subsp. indologenes. Rozróżnienie to ma kluczowe znaczenie praktyczne, ponieważ wyłącznie podgatunek stewartii jest zdolny do wywoływania charakterystycznego więdnięcia Stewarta.
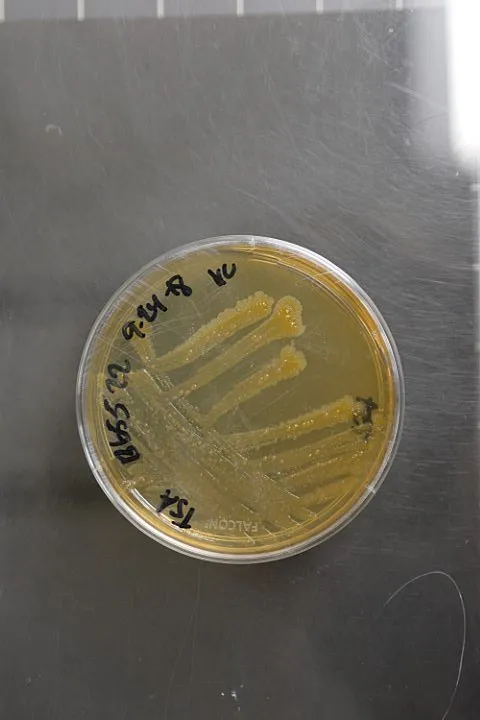
Morfologicznie jest to bakteria Gram-ujemna, bezwiciowa, nietworzące endospor, o kształcie pałeczkowatym o wymiarach 0,4-0,7 × 0,9-2,0 μm. Komórki występują pojedynczo lub w krótkich łańcuchach. Na pożywce nutrient-glucose agar tworzy kolonie o charakterystycznej barwie kremowo-żółtej, cytrynowo-żółtej lub pomarańczowo-żółtej, płaskie, wyniesione lub wypukłe. Kod EPPO dla tego organizmu to ERWIST.
Biologia i cykl rozwojowy
P. stewartii subsp. stewartii charakteryzuje się złożonym cyklem biologicznym ściśle związanym z obecnością wektorów owadzich. Głównym wektorem w Ameryce Północnej jest chrząszcz Chaetocnema pulicaria Melsheimer (Coleoptera: Chrysomelidae), który zimuje w stadium dorosłym i może przenosić bakterie w swoim przewodzie pokarmowym przez całe życie. Chrząszcze te są zdolne do migracji na znaczne odległości poprzez prądy powietrzne, co umożliwia szybkie rozprzestrzenianie się patogena.
Bakteria może przetrwać zimę w glebie, gnoju lub resztkach łodyg kukurydzy, jednak te sposoby przeżywalności są znacznie mniej istotne w porównaniu z wektorami owadzimi. Transmisja z nasion na siewki występuje przy bardzo niskim wskaźniku – nawet w partiach nasion z 1% infekcją ziarniaków. Według badań Guo i współpracowników (1987), bakteria zanika z nasion kukurydzy po 200-250 dniach przechowywania w temperaturze 8-15°C oraz po 110-120 dniach w temperaturze 20-25°C.
Intensywność choroby każdego sezonu jest skorelowana z temperaturą poprzedniej zimy poprzez jej wpływ na przeżywalność wektora owadziego. Zgodnie z modelem prognostycznym Boewe’a (1949), jeśli średnia dobowa temperatura w okresie grudnia-lutego przekracza punkt zamarzania, wektor przeżywa zimę i choroba może być intensywna przy uprawie podatnych odmian. Natomiast gdy średnia temperatura jest niższa niż 3°C, przeżywalność chrząszczyków jest znacznie ograniczona. Wysokie temperatury nasilają objawy chorobowe, podobnie jak wysoki poziom azotu amonowego i fosforu w nawożeniu mineralnym.
Metody diagnostyczne
Diagnostyka P. stewartii subsp. stewartii opiera się na protokole EPPO PM 7/60 (2) z 2016 roku, który przewiduje zastosowanie co najmniej dwóch testów opartych na różnych zasadach biologicznych. Jako testy przesiewowe rekomendowane są immunofluorescencja (IF) oraz real-time PCR, które zostały zwalidowane w ramach projektu Euphresco (2010). Test immunofluorescencji przeprowadza się przy użyciu przeciwciał monoklonalnych, przy czym najlepszą wydajność wykazały produkty firmy Linaris (Dossenheim, DE). Procedura wymaga przygotowania zawiesiny z ekstraktów roślinnych i nasiennych oraz ich rozcieńczeń 10⁹ i 100⁹ w buforze fosforanowym.
Metody molekularne obejmują konwencjonalny PCR oraz real-time PCR opisany przez Tambong i współpracowników (2008). Ze względu na niską czułość konwencjonalnego PCR (≥10⁷ cfu mL⁻¹), wymagana jest dostateczna ilość czystej kultury. Alternatywnie można zastosować analizę multilocus sequence analysis (MLSA) opartą na sekwencjach genów gyrB, rpoB, atpD oraz infB, która umożliwia rozróżnienie P. stewartii subsp. stewartii od bliskiego podgatunku indologenes, mimo wysokiego podobieństwa sekwencji (do 99% dla genu gyrB).
Do testów serologicznych należy ELISA z zestawem firmy Agdia (Elkhart, US) oraz profilowanie kwasów tłuszczowych przy użyciu systemu MIDI (Newark, US) i aparatury Agilent. Izolacja bakterii powinna być przeprowadzona w ciągu 24 godzin na pożywkach King’s B, NBY (nutrient-broth yeast extract agar) lub YPGA (yeast peptone glucose agar) w temperaturze 25-27°C. Charakterystyczne kolonie mają barwę cytrynowo-pomarańczową, są płaskie do wypukłych, przezroczyste z całymi brzegami. W przypadkach krytycznych wymagane jest potwierdzenie patogeniczności według procedur opisanych w Appendix 5 protokołu EPPO.
Znaczenie gospodarcze i straty
Bakteryjne więdnięcie Stewarta stanowi poważne zagrożenie ekonomiczne szczególnie dla upraw kukurydzy cukrowej (sweetcorn), powodując znaczące straty plonów i zwiększoną podatność na zgniliznę łodyg. Pierwsze poważne straty w USA odnotowano dopiero w latach 1930-1931, mimo że choroba była znana już od około 30 lat wcześniej. Straty mogą wynosić od 40 do 100% plonu, jeśli uprawiane są podatne odmiany kukurydzy cukrowej, a rośliny zostają zainfekowane w stadium siewki, co udokumentowali Pataky i współpracownicy (1995).
Rozwój i wprowadzenie odmian odpornych oraz umiarkowanie odpornych znacznie zredukowało straty do minimum, jak wykazał Pataky (2003). W Europie poważne szkody wystąpiły we Włoszech (region Veneto) przed latami 50. XX wieku w związku z importem nasion z USA. Izolowane ogniska choroby pojawiały się w regionie EPPO: najpierw we Włoszech w latach 80. (FAO, 1983; Mazzucchi, 1984), prawdopodobnie związane z nowymi importami nasion, a później w innych krajach, np. w Słowenii (EPPO, 2020b) oraz na Ukrainie (EPPO, 2018).
Kontrola choroby opiera się na stosowaniu odmian odpornych, nasion wolnych od patogena, zaprawianiu nasion oraz wczesnym opryskiwaniu insektycydami w celu redukcji populacji wektorów. We wszystkich krajach europejskich, gdzie wykryto ogniska choroby, wdrożono środki eradykacyjne. Znaczenie ekonomiczne patogena jest na tyle poważne, że uzasadnia kontynuowanie działań mających na celu wykluczenie go z regionu EPPO.
Regulacje prawne i status kwarantannowy
Pantoea stewartii subsp. stewartii posiada status organizmu kwarantannowego o najwyższym priorytecie w systemach ochrony roślin. W klasyfikacji EPPO figuruje na liście A2 (numer 54), co oznacza organizm lokalnie występujący w regionie EPPO, ale podlegający oficjalnej kontroli. W Unii Europejskiej patogen jest sklasyfikowany jako organizm kwarantannowy kategorii A1 zgodnie z Aneksem II A dyrektywy fitosanitarnej, co oznacza organizm nieobecny na terytorium UE i podlegający zakazowi wprowadzania.
Środki fitosanitarne określone w standardzie EPPO PM 3/78 (1) dotyczącym kontroli przesyłek nasion i ziarna zbóż przewidują, że nasiona powinny pochodzić z obszarów wolnych od P. stewartii subsp. stewartii lub przesyłki nasion muszą być testowane. Dostępne są metody testowania nasion opisane przez Lamka i współpracowników (1991), protokół EPPO (2016b) oraz National Seed Health System (NSHS, 2021). Protokół EPPO PM 7/60 (2) z 2016 roku stanowi podstawę diagnostyki tego patogena w laboratoriach urzędowych.
Zaprawianie nasion chemiczne nie jest skuteczne w eliminacji patogena. Alternatywą jest przechowywanie nasion w warunkach sprzyjających eliminacji bakterii – według badań Guo i współpracowników (1987), magazynowanie przez 200-250 dni w temperaturze 8-15°C lub 110-120 dni w 20-25°C prowadzi do zaniku bakterii z materiału siewnego. W przypadku wykrycia ognisk choroby w krajach EPPO obowiązkowe jest wdrożenie środków eradykacyjnych zgodnie ze standardem PM 7/77 dotyczącym raportowania i dokumentacji.